El aire comprimido tiene una variedad de usos en la industria de dispositivos médicos, desde la aplicación de recubrimientos hasta la transferencia de productos y la limpieza de equipos y productos. Debido a que los dispositivos médicos se colocan dentro del cuerpo humano, los productos presentan un riesgo particularmente alto . El cuerpo humano es muy sensible a los materiales invasivos y es responsabilidad de los fabricantes garantizar que los productos que ofrecen cumplan con los estándares de seguridad.
El saneamiento y la limpieza son los aspectos más importantes de la fabricación de dispositivos médicos. Dado que el aire comprimido es un factor crítico en la fabricación de dispositivos médicos, esto también se aplica a los sistemas de aire comprimido. El aire comprimido contaminado puede comprometer la integridad de los productos de dispositivos médicos y poner en riesgo a los consumidores. El aire comprimido debe cumplir con los estándares de calidad de los dispositivos médicos y los fabricantes deben proporcionar una validación de que sus sistemas de aire son limpios, efectivos y no representan ningún riesgo para los consumidores.
Contaminantes y consecuencias
El aceite, las partículas, el vapor de agua y la carga biológica son contaminantes del aire comprimido particularmente peligrosos que pueden afectar a los dispositivos médicos.
El aire sin aceite es fundamental en la fabricación de dispositivos médicos y productos farmacéuticos (Arfalk, 2016). Las especificaciones de sala limpia requieren que no haya aceite presente en los puntos críticos de control. El aceite puede hacer que algunos productos aumenten de tamaño o experimenten un desequilibrio químico (Nortec, 2018). Los compresores de aire sin aceite y la filtración adecuada pueden ayudar a los fabricantes a prevenir y eliminar el aceite del aire.
La contaminación por partículas también puede afectar la seguridad de los productos de dispositivos médicos. Por ejemplo, si hay virutas de metal en la línea de distribución y luego impactan los productos, esto no solo podría dañar la apariencia física del producto, sino también poner en peligro al consumidor.
El aire comprimido se usa a menudo para secar productos de dispositivos médicos y si ese aire está contaminado con vapor de agua, los instrumentos no se secarán por completo (Chobin, 2017). Esto puede causar la degradación de algunos productos y convertirse en un caldo de cultivo para contaminación adicional como microorganismos.
La carga biológica es particularmente peligrosa y una contaminación puede amenazar la seguridad del paciente o dar lugar a una intervención reguladora. Los sistemas de aire comprimido que reciben un mantenimiento inadecuado o que tienen materiales inadecuados pueden introducir bacterias , levaduras o moho en el producto final. Este tipo de contaminación pone a los consumidores en un gran riesgo.
Puntos críticos de control y salvaguardias
El sistema de aire comprimido de un dispositivo médico debe incluir un compresor debidamente mantenido, tuberías y distribución adecuadas y filtros efectivos. Es esencial mantener adecuadamente el sistema, monitorear de cerca las fugas y cambiar los filtros según las recomendaciones del fabricante. Los contaminantes pueden ingresar al sistema en una variedad de lugares, desde la entrada hasta la tubería y una fuga del sistema. Debido a esto, es importante considerar varios puntos del sistema como puntos de control críticos y realizar la prueba como tales. Por ejemplo, realizar pruebas solo en el compresor podría permitir que la contaminación en la línea no se detecte. Monitorear la calidad del aire en una variedad de ubicaciones puede ayudar a los fabricantes a reducir una fuente de contaminación y actuar de manera eficiente para corregirla.
El mantenimiento preventivo y las pruebas son una buena manera de proteger el producto y garantizar que el sistema continúe funcionando de manera eficaz. Elija la tubería, los conectores y las mangueras adecuados y libres de partículas, emplee una filtración eficaz y pruebe los sistemas con regularidad .
Especificaciones para dispositivos médicos
Debido a que no existen estándares específicos para el aire comprimido en la industria de dispositivos médicos, muchos fabricantes trabajan con estándares de sala limpia o crean sus propias especificaciones basadas en una evaluación de riesgos exhaustiva. La USP ( Farmacopea de los Estados Unidos ) y las normas de la Farmacopea europea establecen la importancia de las pruebas de vapor de agua y aceite en productos de dispositivos médicos. El aceite no debe exceder los 0,1 mg / m3 (BPF, 2017). No debe haber agua líquida presente.
De acuerdo con los requisitos de la Regulación del Sistema de Calidad de la FDA , los fabricantes deben establecer y mantener procedimientos para prevenir la contaminación que podría tener efectos adversos en la calidad del producto. Los planes de seguimiento son una forma eficaz de cumplir con estos requisitos.
Un conjunto de normas más específico que se puede utilizar para dispositivos médicos es la ISO 8573 . Siga este estándar internacional con clases de pureza y especificaciones correspondientes para una seguridad óptima.
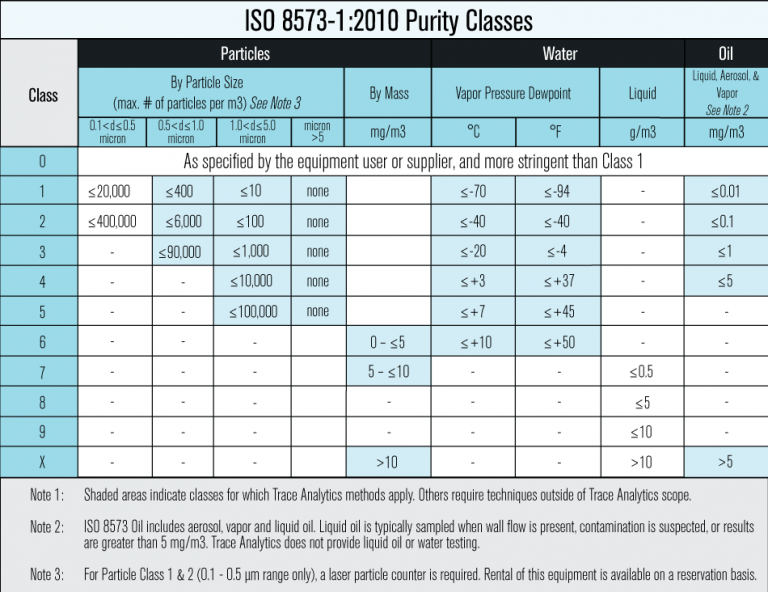
Planes de control y prueba de aire comprimido
La mejor manera de garantizar la calidad del aire comprimido utilizado en la fabricación de dispositivos médicos es mediante pruebas periódicas con un laboratorio acreditado como Trace Analytics, LLC. Las pruebas de diagnóstico pueden ayudar a determinar los niveles de pureza actuales y proporcionar los datos necesarios para construir un plan de monitoreo . Las pruebas de partículas, agua, aceite y microorganismos se pueden realizar fácil y rápidamente con un laboratorio como Trace. Un equipo de expertos, instrucciones y videos paso a paso y resultados sencillos permiten su tranquilidad.
Trace Analytics, LLC puede cumplir con cualquiera de las especificaciones anteriores y trabajar con especificaciones y necesidades individuales. Mantenga la calidad de su aire comprimido con pruebas periódicas.










